Facts About Fluorine
O elemento mais reactivo da Tabela Periódica, o flúor tem uma história violenta na busca da sua descoberta. Apesar das propriedades difíceis e às vezes explosivas do flúor, ele é um elemento vital para humanos e animais, razão pela qual é comumente encontrado na água potável e na pasta de dentes.
Apenas os fatos
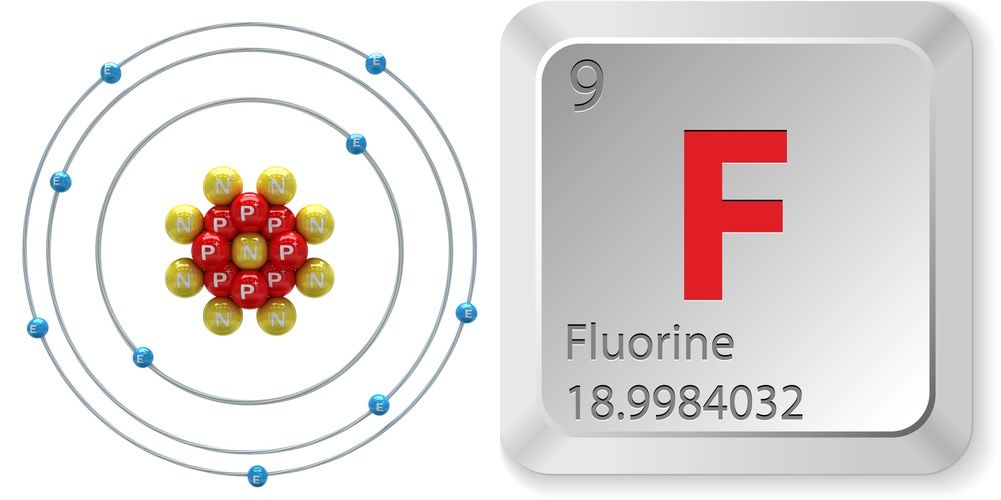
- Número atômico (número de prótons no núcleo): 9
- Símbolo atômico (na Tabela Periódica de Elementos): F
- Peso atómico (massa média do átomo): 18,998
- Densidade: 0,001696 gramas por centímetro cúbico
- Fase à temperatura ambiente: Gás
- Ponto de fusão: menos 363,32 graus Fahrenheit (menos 219,62 graus Celsius)
- Ponto de fusão: menos 306,62 graus F (menos 188,12 graus C)
- Número de isótopos (átomos do mesmo elemento com um número diferente de neutrões): 18
- Isótopos mais comuns: F-19 (100% de abundância natural)
História
Até agora os químicos tentaram durante anos isolar o elemento de vários fluoretos. Não foi até 1986 que o químico alemão Karl O. Christie sintetizou com sucesso o flúor, e relatou seus resultados na revista Inorganic Chemistry. O flúor não ocorre livre na natureza; mas em 2012, pesquisadores encontraram pequenas quantidades de flúor presas em antozonita, um tipo de fluorita radioativa.
Durante séculos, o espatoflúor mineral foi usado no refino de metais. Conhecido hoje como fluoreto de cálcio (CaF2), era usado como fluxo para separar metal puro dos minerais indesejados no minério, de acordo com o Chemicool. O “fluor” vem da palavra latina “fluere”, que significa “fluir”, porque era isso que o espatoflúor permitia aos metais. O mineral também foi chamado de esmeralda boêmia e foi usado em gravura de vidro, segundo o Laboratório Jefferson.
Muitos cientistas ao longo das décadas tentaram experimentar o espatoflúor para melhor aprender suas propriedades, bem como sua composição. Em seus experimentos, os químicos frequentemente produziam ácido fluorídrico (hoje conhecido como ácido fluorídrico, HF), um ácido incrivelmente reativo e perigoso. Mesmo pequenos salpicos deste ácido na pele podem ser fatais, de acordo com o Chemicool. Vários cientistas foram feridos, cegos ou mortos em algumas das experiências.
No início do século XIX, os cientistas Andre-Marie Ampere, na França, e Humphry Davy, na Inglaterra, corresponderam sobre a possibilidade de um novo elemento dentro do ácido. Em 1813, Davy anunciou a descoberta do novo elemento e nomeou-o flúor a partir da sugestão de Ampere.
Henri Moissan, um químico francês, finalmente isolou o flúor em 1886 – depois de ter sido envenenado várias vezes em sua busca. Ele recebeu o Prêmio Nobel em 1906 pelo isolamento do flúor por eletrólise do hidrogênio fluoreto de potássio seco (KHF2) e do ácido fluorídrico seco.
Usos do flúor
Por muitos anos, sais de flúor, ou fluoretos, têm sido usados na soldagem e no congelamento do vidro, de acordo com a Royal Society. Por exemplo, o ácido fluorídrico é usado para gravar o vidro das lâmpadas.
Fluorine é um elemento vital na indústria da energia nuclear, de acordo com a Royal Society. É usado para fazer hexafluoreto de urânio, que é necessário para separar os isótopos de urânio. O hexafluoreto de enxofre é um gás utilizado para isolar transformadores eléctricos de alta potência.
Clorofluorocarbonos (CFC) foram outrora utilizados em aerossóis, frigoríficos, aparelhos de ar condicionado, embalagens de espuma alimentar e extintores de incêndio. Esses usos foram proibidos desde 1996 porque contribuem para o empobrecimento da camada de ozônio, de acordo com os Institutos Nacionais de Saúde. Antes de 2009, os CFC eram usados em inaladores para controlar a asma, mas esses tipos de inaladores foram gradualmente eliminados em 2013.
Fluorine é usado em muitos fluorquímicos, incluindo solventes e plásticos de alta temperatura, como o teflon (poli(tetrafluoroeteno), PTFE). O teflon é bem conhecido por suas propriedades antiaderentes e é usado em frigideiras. É também usado para isolamento de cabos, para fita de canalizador e como base do Gore-Tex® (usado em sapatos e roupas impermeáveis).
Fluorine é adicionado ao abastecimento de água da cidade na proporção de cerca de uma parte por milhão para ajudar a prevenir a cárie dentária, de acordo com o Jefferson Lab. Vários compostos de flúor são adicionados à pasta de dentes, também para ajudar a prevenir cáries dentárias.
Impactos do flúor na saúde e no ambiente
Embora todos os humanos e animais estejam expostos e necessitem de quantidades mínimas de flúor, o elemento em qualquer dose suficientemente grande é extremamente tóxico e perigoso. De acordo com a Lenntech, o flúor pode ser naturalmente encontrado na água, no ar e nos alimentos de origem vegetal e animal em pequenas quantidades. Quantidades maiores de flúor são encontradas em poucos produtos alimentares, como chá e marisco.
Enquanto pequenas quantidades de flúor são essenciais para manter a força dos nossos ossos e dentes, demasiado pode ter o efeito inverso de causar osteoporose ou cárie dentária, assim como pode prejudicar os rins, nervos e músculos.
Na sua forma gasosa, o flúor é incrivelmente perigoso. Pequenas quantidades de gás flúor podem causar irritação nos olhos e nariz, enquanto quantidades maiores podem ser fatais, de acordo com a Lenntech. O ácido fluorídrico, como outro exemplo, também pode se revelar fatal quando mesmo um pequeno respingo na pele ocorre, de acordo com Chemicool.
No ambiente, o flúor, o 13º elemento mais abundante na crosta terrestre, normalmente se instala dentro do solo e se combina facilmente com o solo, rocha, carvão e argila, de acordo com a Lenntech. As plantas podem absorver o flúor do solo, embora altas concentrações possam levar a danos. O milho e os damascos, por exemplo, estão entre as plantas mais susceptíveis a danos e redução do crescimento quando expostas a níveis elevados de flúor.
Quem diria?
- Porque o flúor é o elemento mais quimicamente reativo, ele deve ser manuseado com extremo cuidado, pois às vezes pode explodir ao contato com todos os outros elementos, excluindo oxigênio, hélio, neônio e crípton, de acordo com Chemicool.
- A lã de aço explode em chamas quando exposta ao flúor, de acordo com a Royal Society of Chemistry.
- Fluorine é também o elemento mais eletronegativo. O flúor atrai elétrons mais rapidamente do que qualquer outro elemento.
li>Em média, a quantidade de flúor no corpo humano é de três miligramas.li>Fluorine é minado principalmente na China, Mongólia, Rússia, México e África do Sul, de acordo com Minerals Education Coalition.li>Fluorine é criado em estrelas parecidas com o sol no final de sua vida útil, de acordo com um artigo de 2014 publicado no Astrophysical Journal Letters. O elemento é formado sob as maiores pressões e temperaturas dentro da estrela quando se expande para se tornar um gigante vermelho. Quando as camadas externas da estrela são afastadas criando uma nebulosa planetária, o flúor viaja junto com os outros gases para o meio interestelar, eventualmente formando novas estrelas e planetas.li> De acordo com o Journal of Chemistry, aproximadamente 25% das drogas e medicamentos, incluindo os para o câncer, o sistema nervoso central e o sistema cardiovascular, contêm alguma forma de flúor.
Pesquisa atual
Embora o flúor possa ser tóxico quando a concentração dentro do corpo é muito alta, ele também pode ser um elemento benéfico para incluir em medicamentos contra o câncer, de acordo com um artigo publicado no Journal of Fluorine Chemistry de 2018. De acordo com a pesquisa, a substituição das ligações carbono-hidrogênio ou carbono-oxigênio por uma ligação carbono-fluorina nos componentes ativos do medicamento geralmente mostra uma melhoria da eficácia dos medicamentos, incluindo maior estabilidade metabólica, maior ligação às moléculas alvo e maior permeabilidade da membrana. Espera-se que com o aumento da eficácia dos fármacos, em conjunto com os fármacos alvo específicos do tumor ou com os sistemas de administração de fármacos alvo, a qualidade de vida dos pacientes com cancro possa ser muito melhorada em relação aos métodos tradicionais, como a quimioterapia, em que as células cancerígenas, bem como as células saudáveis, são alvo dos fármacos.
Esta nova geração de fármacos de combate ao cancro, bem como de sondas de flúor para a administração dos fármacos, foi testada contra as células estaminais cancerígenas e demonstrou ser prometedora na detecção e combate às células estaminais cancerígenas, de acordo com o estudo. Os investigadores descobriram que os medicamentos que incluíam flúor eram várias vezes mais activos contra várias células estaminais cancerígenas e apresentavam melhor estabilidade do que os medicamentos tradicionais de combate ao cancro.