Faits sur le fluor
L’élément le plus réactif du tableau périodique, le fluor a une histoire violente dans la quête de sa découverte. Malgré les propriétés difficiles et parfois explosives du fluor, c’est un élément vital pour les humains et les animaux, c’est pourquoi on le trouve couramment dans l’eau potable et le dentifrice.
Les faits
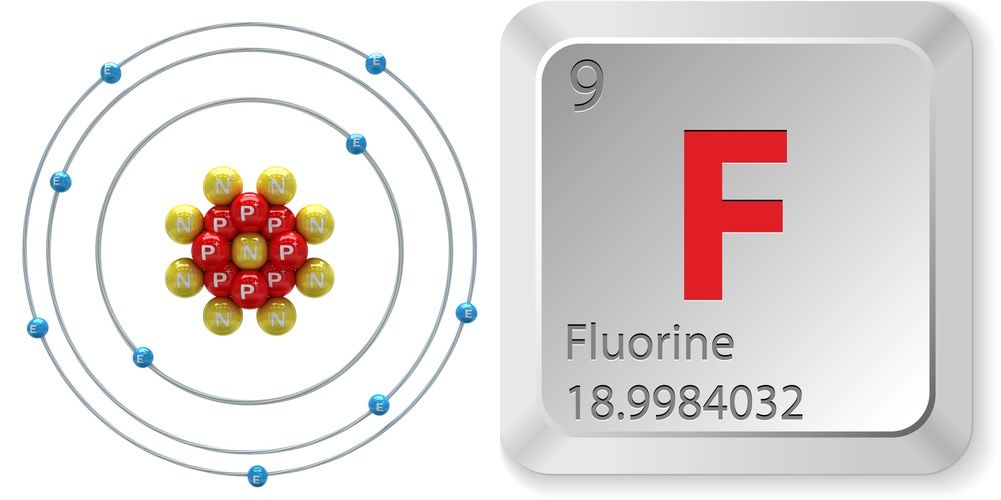
- Numéro atomique (nombre de protons dans le noyau) : 9
- Symbole atomique (sur le tableau périodique des éléments) : F
- Poids atomique (masse moyenne de l’atome) : 18,998
- Densité : 0,001696 gramme par centimètre cube
- Phase à température ambiante : Gaz
- Point de fusion : moins 363,32 degrés Fahrenheit (moins 219,62 degrés Celsius)
- Point d’ébullition : moins 306,62 degrés F (moins 188,12 degrés C)
- Nombre d’isotopes (atomes du même élément avec un nombre différent de neutrons) : 18
- Isotopes les plus courants : F-19 (100 % d’abondance naturelle)
Histoire
Les premiers chimistes ont essayé pendant des années d’isoler l’élément à partir de divers fluorures. Ce n’est qu’en 1986 que le chimiste allemand Karl O. Christie a réussi à synthétiser du fluor, et a rapporté ses résultats dans la revue Inorganic Chemistry. Le fluor n’est pas présent à l’état libre dans la nature ; mais en 2012, des chercheurs ont trouvé de petites quantités de fluor piégées dans l’antozonite, un type de fluorine radioactive.
Pendant des siècles, le minéral fluorine a été utilisé dans le raffinage des métaux. Connu aujourd’hui sous le nom de fluorure de calcium (CaF2), il était utilisé comme flux pour séparer le métal pur des minéraux indésirables dans le minerai, selon Chemicool. Le « fluor » vient du mot latin « fluere », qui signifie « couler », car c’est ce que le spath fluor permettait aux métaux de faire. Le minéral était également appelé émeraude de Bohème et était utilisé dans la gravure du verre, selon le Jefferson Laboratory.
De nombreux scientifiques au cours des décennies ont tenté d’expérimenter le spath fluor pour mieux connaître ses propriétés, ainsi que sa composition. Dans leurs expériences, les chimistes produisaient souvent de l’acide fluorique (aujourd’hui connu sous le nom d’acide hydrofluorique, HF), un acide incroyablement réactif et dangereux. Même de petites éclaboussures de cet acide sur la peau peuvent être fatales, selon Chemicool. Plusieurs scientifiques ont été blessés, aveuglés ou tués dans certaines expériences.
Au début du 19e siècle, les scientifiques André-Marie Ampère, en France, et Humphry Davy, en Angleterre, ont correspondu sur la possibilité d’un nouvel élément au sein de l’acide. En 1813, Davy a annoncé la découverte du nouvel élément et l’a nommé fluor d’après la suggestion d’Ampère.
Henri Moissan, un chimiste français, a finalement isolé le fluor en 1886 – après avoir été empoisonné plusieurs fois dans sa poursuite. Il a obtenu le prix Nobel en 1906 pour l’isolement du fluor par électrolyse de fluorure d’hydrogène de potassium sec (KHF2) et d’acide fluorhydrique sec.
Utilisations du fluor
Depuis de nombreuses années, les sels de fluor, ou fluorures, sont utilisés pour la soudure et pour le dépolissage du verre, selon la Royal Society. Par exemple, l’acide fluorhydrique est utilisé pour graver le verre des ampoules électriques.
Le fluor est un élément vital dans l’industrie de l’énergie nucléaire, selon la Royal Society. Il est utilisé pour fabriquer de l’hexafluorure d’uranium, nécessaire pour séparer les isotopes de l’uranium. L’hexafluorure de soufre est un gaz utilisé pour isoler les transformateurs électriques de haute puissance.
Les chlorofluorocarbones (CFC) étaient autrefois utilisés dans les aérosols, les réfrigérateurs, les climatiseurs, les emballages alimentaires en mousse et les extincteurs. Ces utilisations sont interdites depuis 1996 car elles contribuent à l’appauvrissement de la couche d’ozone, selon les National Institutes of Health. Avant 2009, les CFC étaient utilisés dans les inhalateurs pour contrôler l’asthme, mais ces types d’inhalateurs ont été progressivement abandonnés en 2013.
Le fluor est utilisé dans de nombreux produits chimiques fluorés, notamment des solvants et des plastiques à haute température, comme le téflon (poly(tétrafluoroéthène), PTFE). Le téflon est bien connu pour ses propriétés antiadhésives et est utilisé dans les poêles à frire. Il est également utilisé pour l’isolation des câbles, pour le ruban de plombier et comme base du Gore-Tex® (utilisé dans les chaussures et les vêtements imperméables).
Le fluor est ajouté aux approvisionnements en eau des villes dans la proportion d’environ une partie par million pour aider à prévenir la carie dentaire, selon le Jefferson Lab. Plusieurs composés fluorés sont ajoutés au dentifrice, également pour aider à prévenir la carie dentaire.
Les impacts du fluor sur la santé et l’environnement
Bien que tous les humains et les animaux soient exposés à des quantités infimes de fluor et en aient besoin, l’élément à toute dose suffisamment importante est extrêmement toxique et dangereux. Selon Lenntech, le fluor peut être trouvé naturellement dans l’eau, l’air, et les aliments d’origine végétale et animale en petites quantités. De plus grandes quantités de fluor sont présentes dans quelques produits alimentaires tels que le thé et les crustacés.
Bien que de petites quantités de fluor soient essentielles pour maintenir la solidité de nos os et de nos dents, une trop grande quantité peut avoir l’effet inverse en provoquant de l’ostéoporose ou des caries dentaires, ainsi qu’en nuisant potentiellement aux reins, aux nerfs et aux muscles.
Sous sa forme gazeuse, le fluor est incroyablement dangereux. De petites quantités de gaz fluorés peuvent provoquer une irritation des yeux et du nez, tandis que de plus grandes quantités peuvent être fatales, selon Lenntech. L’acide fluorhydrique, comme autre exemple, peut également s’avérer fatal lorsque même une petite éclaboussure sur la peau se produit, selon Chemicool.
Dans l’environnement, le fluor, le 13e élément le plus abondant dans la croûte terrestre, se dépose généralement dans le sol et se combine facilement avec la terre, la roche, le charbon et l’argile, selon Lenntech. Les plantes peuvent absorber le fluor du sol, bien que des concentrations élevées puissent entraîner des dommages. Le maïs et les abricots, par exemple, sont parmi les plantes les plus susceptibles d’être endommagées et de voir leur croissance réduite lorsqu’elles sont exposées à des niveaux élevés de fluor.
Qui l’aurait cru ?
- Parce que le fluor est l’élément le plus réactif chimiquement, il doit être manipulé avec une extrême prudence car il peut parfois exploser au contact de tous les autres éléments à l’exception de l’oxygène, de l’hélium, du néon et du krypton, selon Chemicool.
- La laine d’acier s’enflamme lorsqu’elle est exposée au fluor, selon la Royal Society of Chemistry.
- Le fluor est également l’élément le plus électronégatif. Le fluor attire les électrons plus facilement que tout autre élément.
- En moyenne, la quantité de fluor dans le corps humain est de trois milligrammes.
- Le fluor est principalement extrait en Chine, en Mongolie, en Russie, au Mexique et en Afrique du Sud, selon la Minerals Education Coalition.
- Le fluor est créé dans les étoiles semblables au soleil vers la fin de leur vie, selon un article de 2014 publié dans l’Astrophysical Journal Letters. L’élément se forme sous les pressions et les températures plus élevées au sein de l’étoile lorsqu’elle se dilate pour devenir une géante rouge. Lorsque les couches externes de l’étoile sont repoussées, créant ainsi une nébuleuse planétaire, le fluor voyage avec les autres gaz dans le milieu interstellaire pour finalement former de nouvelles étoiles et planètes.
- Selon le Journal of Chemistry, environ 25 % des drogues et des médicaments, y compris ceux pour le cancer, le système nerveux central et le système cardiovasculaire, contiennent une forme de fluor.
Recherche actuelle
Bien que le fluor puisse être toxique lorsque sa concentration dans l’organisme est trop élevée, il peut également être un élément bénéfique à inclure dans les médicaments contre le cancer, selon un article de 2018 publié dans le Journal of Fluorine Chemistry. Selon la recherche, le remplacement des liaisons carbone-hydrogène ou carbone-oxygène par une liaison carbone-fluor dans les composants actifs du médicament montre généralement une amélioration de l’efficacité des médicaments, notamment une stabilité métabolique plus élevée, une liaison accrue aux molécules cibles et une meilleure perméabilité membranaire. On espère qu’avec l’efficacité accrue des médicaments, en conjonction avec des médicaments cibles spécifiques à la tumeur ou des systèmes d’administration de médicaments ciblés, la qualité de vie des patients atteints de cancer pourra être grandement améliorée par rapport aux méthodes traditionnelles telles que la chimiothérapie, dans laquelle les cellules cancéreuses, ainsi que les cellules saines, sont ciblées par les médicaments.
Cette nouvelle génération de médicaments anticancéreux, ainsi que les sondes fluorées pour administrer les médicaments, a été testée contre les cellules souches cancéreuses et s’est avérée prometteuse pour cibler et combattre les cellules souches cancéreuses, selon l’étude. Les chercheurs ont constaté que les médicaments qui incluaient du fluor étaient plusieurs fois plus actifs contre diverses cellules souches cancéreuses et présentaient une meilleure stabilité que les médicaments anticancéreux traditionnels.