Fapte despre fluor
Elementul cel mai reactiv din tabelul periodic, fluorul are o istorie violentă în încercarea de a-l descoperi. În ciuda proprietăților dificile și uneori explozive ale fluorului, acesta este un element vital pentru oameni și animale, motiv pentru care se găsește în mod obișnuit în apa potabilă și în pasta de dinți.
Doar câteva date
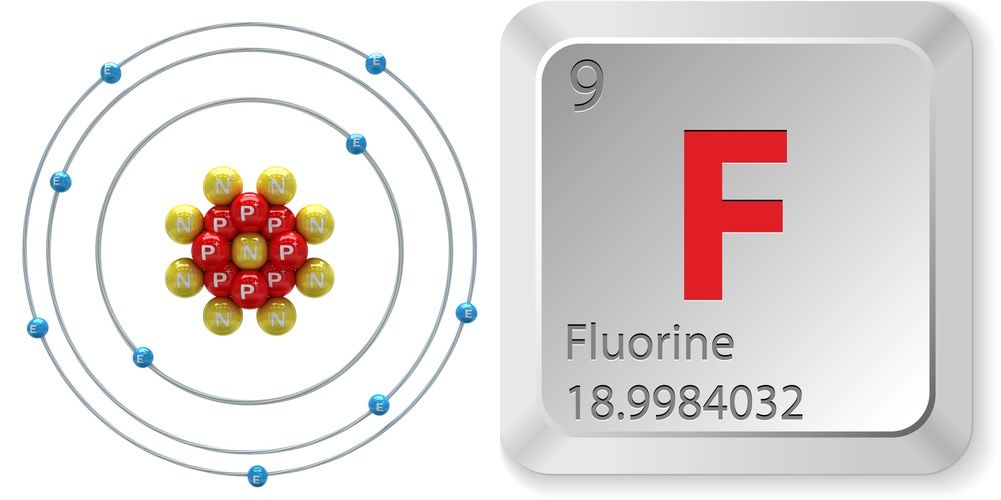
- Numărul atomic (numărul de protoni din nucleu): 9
- Simbolul atomic (în tabelul periodic al elementelor): 9
- Simbolul atomic (în tabelul periodic al elementelor): 9
- : F
- Greutate atomică (masa medie a atomului): 18,998
- Densitate: 0,001696 grame pe centimetru cub
- Fază la temperatura camerei: Gaz
- Punctul de topire: minus 363,32 grade Fahrenheit (minus 219,62 grade Celsius)
- Punctul de fierbere: minus 306,62 grade F (minus 188,12 grade C)
- Numărul de izotopi (atomi ai aceluiași element cu un număr diferit de neutroni): 18
- Cei mai comuni izotopi: F-19 (abundență naturală de 100 la sută)
Istoric
Primarii chimiști au încercat ani de zile să izoleze elementul din diverse fluoruri. Abia în 1986, chimistul german Karl O. Christie a reușit să sintetizeze cu succes fluorul și și-a raportat rezultatele în revista Inorganic Chemistry. Fluorul nu se găsește liber în natură; însă, în 2012, cercetătorii au descoperit cantități mici de fluor prins în antozonit, un tip de fluorit radioactiv.
Pentru secole, mineralul fluorspar a fost folosit în rafinarea metalelor. Cunoscut astăzi sub numele de fluorură de calciu (CaF2), a fost folosit ca un fondant pentru a separa metalul pur de mineralele nedorite din minereu, potrivit Chemicool. Cuvântul „fluor” provine din cuvântul latin „fluere”, care înseamnă „a curge”, pentru că asta a permis fluorsparului să facă metalele. Mineralul a mai fost numit și smarald de Boemia și a fost folosit la gravarea sticlei, potrivit Jefferson Laboratory.
Mulți oameni de știință au încercat de-a lungul deceniilor să experimenteze cu fluorsparul pentru a-i cunoaște mai bine proprietățile, precum și compoziția. În experimentele lor, chimiștii au produs adesea acid fluoric (cunoscut astăzi sub numele de acid fluorhidric, HF), un acid incredibil de reactiv și periculos. Chiar și stropi mici de acest acid pe piele pot fi fatali, potrivit Chemicool. Mai mulți oameni de știință au fost răniți, orbiți sau uciși în unele dintre experimente.
La începutul secolului al XIX-lea, oamenii de știință Andre-Marie Ampere, din Franța, și Humphry Davy, din Anglia, au corespondat despre posibilitatea existenței unui nou element în cadrul acidului. În 1813, Davy a anunțat descoperirea noului element și l-a numit fluor la sugestia lui Ampere.
Henri Moissan, un chimist francez, a izolat în cele din urmă fluorul în 1886 – după ce a fost otrăvit de mai multe ori în urmărirea sa. El a primit Premiul Nobel în 1906 pentru izolarea fluorului prin electroliza fluorurii uscate de hidrogen fluorurat de potasiu (KHF2) și a acidului fluorhidric uscat.
Utilizări ale fluorului
Pentru mulți ani, sărurile de fluor, sau fluorurile, au fost folosite la sudură și pentru glazurarea sticlei, potrivit Royal Society. De exemplu, acidul fluorhidric este folosit pentru a grava sticla becurilor.
Fluorul este un element vital în industria energiei nucleare, potrivit Royal Society. Este folosit pentru a produce hexafluorură de uraniu, care este necesară pentru a separa izotopii de uraniu. Hexafluorura de sulf este un gaz folosit pentru izolarea transformatoarelor electrice de mare putere.
Clorofluorocarburile (CFC) au fost folosite cândva în aerosoli, frigidere, aparate de aer condiționat, ambalaje alimentare din spumă și stingătoare de incendii. Aceste utilizări au fost interzise din 1996, deoarece contribuie la epuizarea stratului de ozon, potrivit National Institutes of Health. Înainte de 2009, CFC-urile erau folosite în inhalatoare pentru controlul astmului, dar aceste tipuri de inhalatoare au fost eliminate treptat în 2013.
Fluorul este utilizat în multe produse fluorochimice, inclusiv în solvenți și în materiale plastice de înaltă temperatură, cum ar fi Teflon (poli(tetrafluoroetena), PTFE). Teflonul este bine cunoscut pentru proprietățile sale antiaderente și este utilizat la tigăile pentru prăjit. Este, de asemenea, utilizat pentru izolarea cablurilor, pentru banda de instalator și ca bază pentru Gore-Tex® (utilizat în pantofii și îmbrăcămintea impermeabilă).
Fluorul este adăugat în rezervele de apă ale orașelor în proporție de aproximativ o parte la milion pentru a ajuta la prevenirea cariilor dentare, potrivit Jefferson Lab. Mai mulți compuși de fluor sunt adăugați în pasta de dinți, tot pentru a ajuta la prevenirea cariilor dentare.
Impactul fluorului asupra sănătății și mediului
Deși toți oamenii și animalele sunt expuși și au nevoie de cantități infime de fluor, elementul în orice doză suficient de mare este extrem de toxic și periculos. Potrivit Lenntech, fluorul poate fi găsit în mod natural în apă, aer și atât în alimentele de origine vegetală, cât și animală, în cantități mici. Cantități mai mari de fluor se găsesc în câteva produse alimentare, cum ar fi ceaiul și crustaceele.
În timp ce cantități mici de fluor sunt esențiale pentru menținerea rezistenței oaselor și a dinților noștri, o cantitate prea mare poate avea efectul invers, provocând osteoporoză sau carii dentare, precum și un potențial dăunător pentru rinichi, nervi și mușchi.
În forma sa gazoasă, fluorul este incredibil de periculos. Cantități mici de fluor gazos pot provoca iritații ale ochilor și nasului, în timp ce cantități mai mari pot fi fatale, potrivit Lenntech. Acidul fluorhidric, ca un alt exemplu, se poate dovedi, de asemenea, fatal atunci când are loc chiar și o mică stropire pe piele, potrivit Chemicool.
În mediul înconjurător, fluorul, al 13-lea cel mai abundent element din scoarța terestră, se depune de obicei în sol și se combină ușor cu solul, rocile, cărbunele și argila, potrivit Lenntech. Plantele pot absorbi fluorul din sol, deși concentrațiile mari pot duce la deteriorări. Porumbul și caisele, de exemplu, se numără printre plantele care sunt cele mai sensibile la deteriorări și la reducerea creșterii atunci când sunt expuse la niveluri ridicate de fluor.
Cine știa?
- Pentru că fluorul este elementul cel mai reactiv din punct de vedere chimic, trebuie manevrat cu mare grijă, deoarece uneori poate exploda la contactul cu toate celelalte elemente, cu excepția oxigenului, heliului, neonului și kriptonului, potrivit Chemicool.
- Lâna de oțel izbucnește în flăcări atunci când este expusă la fluor, potrivit Societății Regale de Chimie.
- Fluorul este, de asemenea, elementul cel mai electronegativ. Fluorul atrage electronii mai ușor decât orice alt element.
- În medie, cantitatea de fluor din corpul uman este de trei miligrame.
- Fluorul este exploatat în principal în China, Mongolia, Rusia, Mexic și Africa de Sud, potrivit Minerals Education Coalition.
- Fluorul este creat în stelele asemănătoare soarelui spre sfârșitul vieții lor, potrivit unui articol din 2014 publicat în Astrophysical Journal Letters. Elementul se formează sub presiunile și temperaturile mai ridicate din interiorul stelei atunci când aceasta se extinde pentru a deveni o gigantă roșie. Atunci când straturile exterioare ale stelei sunt împinse departe, creând o nebuloasă planetară, fluorul călătorește împreună cu celelalte gaze în mediul interstelar, formând în cele din urmă noi stele și planete.
- Potrivit Journal of Chemistry, aproximativ 25 la sută din droguri și medicamente, inclusiv cele pentru cancer, sistemul nervos central și sistemul cardiovascular, conțin o anumită formă de fluor.
Cercetări actuale
Deși fluorul poate fi toxic atunci când concentrația în organism este prea mare, acesta poate fi, de asemenea, un element benefic pentru a fi inclus în medicamentele împotriva cancerului, potrivit unui articol din 2018 publicat în Journal of Fluorine Chemistry. Potrivit cercetării, înlocuirea legăturilor carbon-hidrogen sau carbon-oxigen cu o legătură carbon-fluor în componentele active ale medicamentului prezintă, de obicei, o îmbunătățire a eficacității medicamentelor, inclusiv o stabilitate metabolică mai mare, o legare sporită la moleculele țintă și o permeabilitate sporită a membranei. Se speră că, odată cu eficiența sporită a medicamentelor, în combinație cu medicamente țintă specifice tumorilor sau cu sisteme de eliberare a medicamentelor țintite, calitatea vieții pacienților cu cancer poate fi mult îmbunătățită față de metodele tradiționale, cum ar fi chimioterapia, în care celulele canceroase, precum și celulele sănătoase, sunt vizate de medicamente.
Această nouă generație de medicamente care luptă împotriva cancerului, precum și sondele cu fluor pentru eliberarea medicamentelor, a fost testată împotriva celulelor stem canceroase și s-a dovedit promițătoare în ceea ce privește țintirea și combaterea celulelor stem canceroase, potrivit studiului. Cercetătorii au descoperit că medicamentele care au inclus fluor au fost de câteva ori mai active împotriva diferitelor celule stem canceroase și au prezentat o stabilitate mai bună decât medicamentele tradiționale de combatere a cancerului.
.