Fakta o fluoru
Fluor, nejreaktivnější prvek periodické tabulky, má za sebou bouřlivou historii při hledání svého objevu. Navzdory obtížným a někdy výbušným vlastnostem fluoru je to pro lidi a zvířata životně důležitý prvek, proto se běžně vyskytuje v pitné vodě a zubních pastách.
Jen fakta
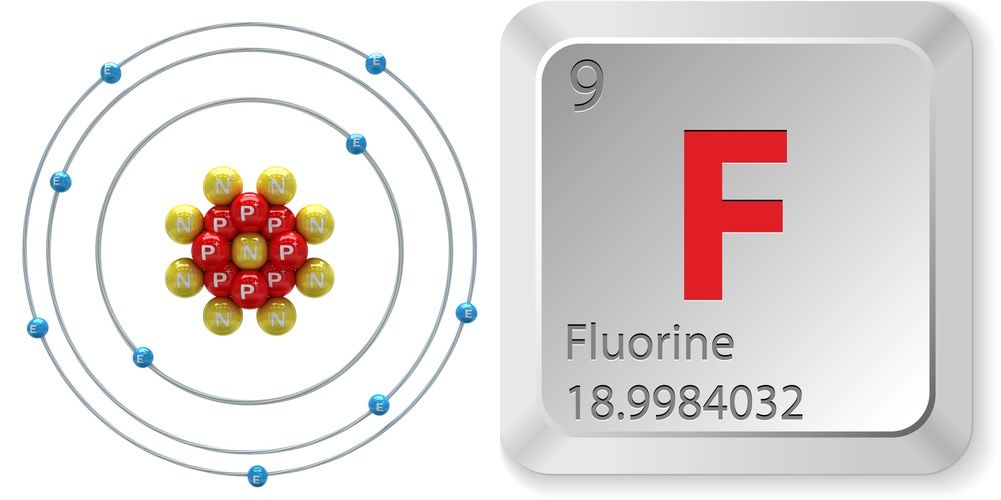
- Atomové číslo (počet protonů v jádře): 9
- Atomová značka (v periodické tabulce prvků): F
- Atomová hmotnost (průměrná hmotnost atomu): 18,998
- Hustota: 0,001696 gramů na centimetr krychlový
- Fáze při pokojové teplotě:
- Teplota tání: minus 363,32 stupňů Fahrenheita (minus 219,62 stupňů Celsia)
- Teplota varu: minus 306,62 stupňů F (minus 188,12 stupňů C)
- Počet izotopů (atomy téhož prvku s různým počtem neutronů): 18
- Nejčastější izotopy: F-19 (100 % přirozený výskyt)
Historie
Přední chemici se léta snažili izolovat prvek z různých fluoridů. Teprve v roce 1986 německý chemik Karl O. Christie úspěšně syntetizoval fluor a o svých výsledcích informoval v časopise Inorganic Chemistry. Fluor se v přírodě volně nevyskytuje, ale v roce 2012 vědci našli malé množství fluoru zachycené v antozonitu, druhu radioaktivního fluoritu.
Po staletí se minerál fluorit používal při rafinaci kovů. Dnes je známý jako fluorid vápenatý (CaF2) a podle společnosti Chemicool se používal jako tavidlo k oddělení čistého kovu od nežádoucích minerálů v rudě. Slovo „fluor“ pochází z latinského slova „fluere“, což znamená „proudit“, protože právě to fluorit umožňoval kovům. Podle Jeffersonovy laboratoře se minerálu říkalo také český smaragd a používal se při leptání skla.
Mnoho vědců se v průběhu desetiletí pokoušelo s fluoritem experimentovat, aby lépe poznali jeho vlastnosti i složení. Při svých pokusech chemici často vyráběli kyselinu fluorovou (dnes známou jako kyselina fluorovodíková, HF), neuvěřitelně reaktivní a nebezpečnou kyselinu. Podle společnosti Chemicool může být i malé postříkání kůže touto kyselinou smrtelné. Při některých pokusech bylo několik vědců zraněno, oslepeno nebo zabito.
Na počátku 19. století si vědci Andre-Marie Ampere ve Francii a Humphry Davy v Anglii dopisovali o možnosti výskytu nového prvku v kyselině. V roce 1813 Davy oznámil objev nového prvku a z Ampereho podnětu jej pojmenoval fluor.
Francouzský chemik Henri Moissan nakonec v roce 1886 fluor izoloval – poté, co byl při své snaze několikrát otráven. Za izolaci fluoru elektrolýzou suchého fluorovodíku draselného (KHF2) a suché kyseliny fluorovodíkové získal v roce 1906 Nobelovu cenu.
Využití fluoru
Podle Královské společnosti se soli fluoru neboli fluoridy již mnoho let používají při svařování a k matování skla. Kyselina fluorovodíková se například používá k leptání skla žárovek.
Fluor je podle Královské společnosti důležitým prvkem v jaderné energetice. Používá se k výrobě hexafluoridu uranu, který je potřebný k separaci izotopů uranu. Hexafluorid sírový je plyn, který se používá k izolaci vysoce výkonných elektrických transformátorů.
Chlorfluoruhlovodíky (CFC) se kdysi používaly v aerosolech, chladničkách, klimatizacích, pěnových obalech na potraviny a hasicích přístrojích. Tato použití jsou od roku 1996 zakázána, protože podle Národního zdravotního ústavu přispívají k poškozování ozonové vrstvy. Před rokem 2009 se freony používaly v inhalátorech proti astmatu, ale tyto typy inhalátorů byly v roce 2013 vyřazeny.
Fluor se používá v mnoha fluorochemikáliích, včetně rozpouštědel a vysokoteplotních plastů, jako je teflon (poly(tetrafluoreten), PTFE). Teflon je dobře známý pro své nepřilnavé vlastnosti a používá se ve fritovacích hrncích. Používá se také pro izolaci kabelů, pro instalatérské pásky a jako základ materiálu Gore-Tex® (používaného v nepromokavých botách a oděvech).
Fluor se podle Jeffersonovy laboratoře přidává do městských vodovodů v poměru asi jeden díl na milion, aby se zabránilo vzniku zubního kazu. Do zubní pasty se přidává několik sloučenin fluoru, které rovněž pomáhají předcházet zubnímu kazu.
Vliv fluoru na zdraví a životní prostředí
Ačkoli jsou všichni lidé a zvířata vystaveni nepatrnému množství fluoru a potřebují ho, je tento prvek v jakékoli dostatečně velké dávce extrémně toxický a nebezpečný. Podle společnosti Lenntech se fluor v malém množství přirozeně vyskytuje ve vodě, vzduchu a potravinách rostlinného i živočišného původu. Větší množství fluoru se nachází v několika potravinách, například v čaji a korýších.
Malé množství fluoru je sice nezbytné pro udržení pevnosti našich kostí a zubů, ale jeho nadměrné množství může mít opačný účinek a způsobit osteoporózu nebo zubní kaz a také potenciálně poškodit ledviny, nervy a svaly.
Ve své plynné formě je fluor neuvěřitelně nebezpečný. Podle společnosti Lenntech může malé množství plynného fluoru způsobit podráždění očí a nosu, zatímco větší množství může být smrtelné. Dalším příkladem je kyselina fluorovodíková, která může být podle společnosti Chemicool smrtelná i při malém postříkání kůže.
V životním prostředí se fluor, 13. nejrozšířenější prvek v zemské kůře, podle společnosti Lenntech obvykle usazuje v půdě a snadno se slučuje s půdou, horninami, uhlím a jílem. Rostliny mohou fluor z půdy absorbovat, i když vysoké koncentrace mohou vést k jeho poškození. Například kukuřice a meruňky patří mezi rostliny, které jsou při vystavení zvýšenému množství fluoru nejnáchylnější k poškození a omezení růstu.
Kdo by to byl řekl?
- Protože je fluor chemicky nejreaktivnější prvek, musí se s ním zacházet velmi opatrně, protože podle společnosti Chemicool může někdy při kontaktu se všemi ostatními prvky s výjimkou kyslíku, helia, neonu a kryptonu explodovat.
- Podle Královské chemické společnosti vzplane ocelová vlna při kontaktu s fluorem.
- Fluor je také nejelektronegativnější prvek. Fluor přitahuje elektrony snadněji než kterýkoli jiný prvek.
- Průměrné množství fluoru v lidském těle činí tři miligramy.
- Fluor se podle organizace Minerals Education Coalition těží především v Číně, Mongolsku, Rusku, Mexiku a Jihoafrické republice.
- Fluor vzniká ve hvězdách podobných Slunci ke konci jejich života, jak uvádí článek publikovaný v roce 2014 v časopise Astrophysical Journal Letters. Prvek vzniká za vyšších tlaků a teplot uvnitř hvězdy, když se rozpíná a stává se červeným obrem. Když se vnější vrstvy hvězdy odtlačí a vytvoří planetární mlhovinu, fluor spolu s ostatními plyny putuje do mezihvězdného prostředí, kde nakonec vzniknou nové hvězdy a planety.
- Podle časopisu Journal of Chemistry přibližně 25 % léků a léčiv, včetně těch na rakovinu, centrální nervový systém a kardiovaskulární systém, obsahuje nějakou formu fluoru.
Současný výzkum
Ačkoli fluor může být při příliš vysoké koncentraci v těle toxický, může být podle článku publikovaného v roce 2018 v časopise Journal of Fluorine Chemistry také prospěšným prvkem, který je součástí léků proti rakovině. Podle výzkumu se nahrazení vazeb uhlík-vodík nebo uhlík-kyslík vazbou uhlík-fluor v aktivních složkách léku obvykle projeví zlepšením účinnosti léků, včetně vyšší metabolické stability, zvýšení vazby na cílové molekuly a zlepšení propustnosti membrán. Doufá se, že se zvýšenou účinností léků ve spojení s cílovými léky specifickými pro nádor nebo cílenými systémy pro doručování léků se může výrazně zlepšit kvalita života pacientů s rakovinou oproti tradičním metodám, jako je chemoterapie, při níž jsou léky cíleny jak na rakovinné, tak na zdravé buňky.
Tato nová generace léků pro boj s rakovinou, stejně jako fluorové sondy pro doručování léků, byla testována proti kmenovým buňkám rakoviny a podle studie se ukázala jako slibná v cílení a boji proti kmenovým buňkám rakoviny. Vědci zjistili, že léky, které obsahovaly fluor, byly několikanásobně aktivnější proti různým rakovinným kmenovým buňkám a vykazovaly lepší stabilitu než tradiční léky proti rakovině.