Fakta om fluor
Fluor är det mest reaktiva grundämnet i det periodiska systemet och har en våldsam historia i jakten på att bli upptäckt. Trots de svåra och ibland explosiva egenskaperna hos fluor är det ett livsviktigt grundämne för människor och djur, vilket är anledningen till att det är vanligt förekommande i dricksvatten och tandkräm.
Bara fakta
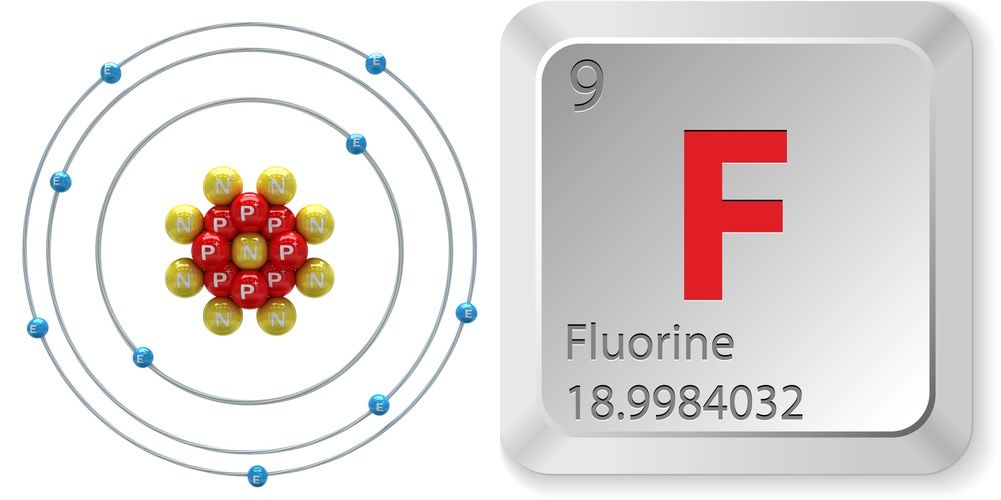
- Atomnummer (antal protoner i kärnan): 9
- Atomsymbol (i det periodiska systemet för grundämnen): 9
- Atomsymbol (i det periodiska systemet för grundämnen): F
- Atomvikt (atomens genomsnittliga massa): 18,998
- Densitet: 0,001696 gram per kubikcentimeter
- Fas vid rumstemperatur: Gas
- Smältpunkt: minus 363,32 grader Fahrenheit (minus 219,62 grader Celsius)
- Kokpunkt: minus 306,62 grader F (minus 188,12 grader C)
- Antal isotoper (atomer av samma grundämne med olika antal neutroner): 18
- Första vanligaste isotoper: F-19 (100 procent naturlig förekomst)
Historia
Förra kemister försökte i åratal att isolera grundämnet från olika fluorider. Det var inte förrän 1986 som den tyske kemisten Karl O. Christie lyckades syntetisera fluor och rapporterade sina resultat i tidskriften Inorganic Chemistry. Fluor förekommer inte fritt i naturen, men 2012 fann forskare små mängder fluor instängda i antozonit, en typ av radioaktiv fluorit.
I århundraden användes mineralen flusspat vid metallförädling. Det är idag känt som kalciumfluorid (CaF2) och användes som flussmedel för att separera ren metall från oönskade mineraler i malm, enligt Chemicool. ”Fluor” kommer från det latinska ordet ”fluere”, som betyder ”flyta”, eftersom det var det som flusspat gjorde det möjligt för metaller att flyta. Mineralen kallades också bohemisk smaragd och användes i glasets etsning, enligt Jefferson Laboratory.
Många forskare har under årtionden försökt experimentera med flusspat för att bättre lära sig dess egenskaper, liksom dess sammansättning. I sina experiment framställde kemisterna ofta fluorsyra (idag känd som fluorvätesyra, HF), en otroligt reaktiv och farlig syra. Även små stänk av denna syra på huden kan vara dödliga, enligt Chemicool. Flera forskare skadades, bländades eller dödades i några av experimenten.
I början av 1800-talet korresponderade vetenskapsmännen Andre-Marie Ampere i Frankrike och Humphry Davy i England om möjligheten av ett nytt grundämne i syran. År 1813 tillkännagav Davy upptäckten av det nya grundämnet och gav det namnet fluor efter Amperes förslag.
Henri Moissan, en fransk kemist, isolerade slutligen fluor 1886 – efter att ha blivit förgiftad flera gånger i sin strävan. Han tilldelades Nobelpriset 1906 för att ha isolerat fluor genom elektrolys av torr kaliumvätefluorid (KHF2) och torr fluorvätesyra.
Användning av fluor
Under många år har fluorsalter, eller fluorider, använts vid svetsning och för att frosta glas, enligt Royal Society. Fluorvätesyra används till exempel för att etsa glaset i glödlampor.
Fluor är ett viktigt element inom kärnkraftsindustrin, enligt Royal Society. Det används för att göra uranhexafluorid, som behövs för att separera uranisotoper. Svavelhexafluorid är en gas som används för att isolera högeffektiva eltransformatorer.
Khlorfluorkarboner (CFC) användes en gång i aerosoler, kylskåp, luftkonditioneringsapparater, livsmedelsförpackningar av skum och brandsläckare. Dessa användningsområden är förbjudna sedan 1996 eftersom de bidrar till nedbrytning av ozonskiktet, enligt National Institutes of Health. Före 2009 användes klorfluorkarboner i inhalatorer för att kontrollera astma, men dessa typer av inhalatorer fasades ut 2013.
Fluor används i många fluorkemikalier, bland annat i lösningsmedel och högtemperaturplaster som t.ex. teflon (poly(tetrafluoreten), PTFE). Teflon är välkänt för sina non-stick-egenskaper och används i stekpannor. Det används också för kabelisolering, för rörmokartongstejp och som grund för Gore-Tex® (som används i vattentäta skor och kläder).
Fluor tillsätts i stadens vattenförsörjning i en proportion av ungefär en del per miljon för att hjälpa till att förhindra karies, enligt Jefferson Lab. Flera fluorföreningar tillsätts i tandkräm, också för att hjälpa till att förebygga karies.
Hälso- och miljöeffekter av fluor
Och även om alla människor och djur exponeras för och behöver små mängder fluor är grundämnet i tillräckligt stora doser extremt giftigt och farligt. Enligt Lenntech finns fluor naturligt i små mängder i vatten, luft och både vegetabiliska och animaliska livsmedel. Större mängder fluor finns i några få livsmedelsprodukter som te och skaldjur.
Och även om små mängder fluor är viktigt för att upprätthålla styrkan i våra ben och tänder, kan för mycket fluor få den omvända effekten att orsaka benskörhet eller tandförfall, samt potentiellt skada njurar, nerver och muskler.
I sin gasform är fluor otroligt farligt. Små mängder fluorgas kan orsaka irritation i ögon och näsa medan större mängder kan vara dödliga, enligt Lenntech. Fluorvätesyra, som ett annat exempel, kan också visa sig vara dödlig när även en liten stänk på huden inträffar, enligt Chemicool.
I miljön lägger sig fluor, som är det 13:e vanligaste grundämnet i jordskorpan, vanligen i marken och kombineras lätt med jord, sten, kol och lera, enligt Lenntech. Växter kan absorbera fluor från jorden, även om höga koncentrationer kan leda till skador. Majs och aprikoser är till exempel bland de växter som är mest mottagliga för skador och minskad tillväxt när de utsätts för förhöjda fluorhalter.
Vem visste?
- Eftersom fluor är det mest kemiskt reaktiva grundämnet måste det hanteras med yttersta försiktighet eftersom det ibland kan explodera vid kontakt med alla andra grundämnen utom syre, helium, neon och krypton, enligt Chemicool.
- Stålull spricker upp i lågor när det utsätts för fluor, enligt Royal Society of Chemistry.
- Fluor är också det mest elektronegativa grundämnet. Fluor drar till sig elektroner lättare än något annat grundämne.
- Mängden fluor i människokroppen är i genomsnitt tre milligram.
- Fluor bryts främst i Kina, Mongoliet, Ryssland, Mexiko och Sydafrika, enligt Minerals Education Coalition.
- Fluor bildas i solliknande stjärnor mot slutet av deras livstid, enligt en artikel från 2014 som publicerades i Astrophysical Journal Letters. Grundämnet bildas under de högre trycken och temperaturerna i stjärnan när den expanderar för att bli en röd jätte. När stjärnans yttre lager trycks bort och skapar en planetarisk nebulosa, färdas fluoret tillsammans med de andra gaserna in i det interstellära mediet och bildar så småningom nya stjärnor och planeter.
- Enligt Journal of Chemistry innehåller cirka 25 procent av alla läkemedel och mediciner, bland annat mot cancer, det centrala nervsystemet och hjärt- och kärlsystemet, någon form av fluor.
Aktuell forskning
Och även om fluor kan vara giftigt när koncentrationen i kroppen är för hög, kan det också vara ett fördelaktigt element att inkludera i cancerläkemedel, enligt en artikel från 2018 som publicerades i Journal of Fluorine Chemistry. Enligt forskningen visar ersättning av kol-väte- eller kol-oxygenbindningar med en kol-fluorbindning i läkemedlets aktiva komponenter vanligtvis en förbättring av läkemedlens effektivitet, inklusive högre metabolisk stabilitet, ökad bindning till målmolekyler och förbättrad membranpermeabilitet. Förhoppningen är att med läkemedlens ökade effektivitet, i kombination med tumörspecifika målmediciner eller målinriktade system för läkemedelstillförsel, kan cancerpatienters livskvalitet förbättras avsevärt jämfört med traditionella metoder som kemoterapi, där såväl cancerceller som friska celler är målinriktade av läkemedlen.
Denna nya generation av cancerbekämpande läkemedel, liksom fluorsonder för att leverera läkemedlen, har testats mot cancerstamceller och visat sig lovande när det gäller att rikta in sig på och bekämpa cancerstamcellerna, enligt studien. Forskarna fann att de läkemedel som innehöll fluor var flera gånger mer aktiva mot olika cancerstamceller och uppvisade bättre stabilitet än traditionella cancerbekämpningsläkemedel.